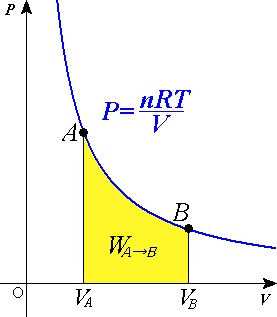
Esta curva es llamada curva "isoterma", es una línea que sobre una gráfica representa los valores suscesivos de las diversas variables de un sistema en un proceso isotermo.Las curvas isotermas de un gas ideal en una gráfica P frente a V, llamada "diagrama de Clapeyron", son hipérbolas equiláteras, cuya ecuación es PV=cte.
A continuacion vemos la simulacion de un gas ideal en 3 dimensiones chocando con las paredes del recipiente, donde una de las paredes es movil.