Hemos visto como la energia interna, U, de un sistema varia porque varia la energia de sus particulas, esta energia puede variar de dos formas: a nivel microscopico o a nivel macroscopico. Entendemos transferencia de energia a nivel microscopico la que realizan dos sistemas al ponerse en contacto termico es decir, las particulas de un sistema pueden chocar con las del otro por lo que las que tienen mas energia: mas temperatura, cederan energia a las del sistema con menor temperatura, esta transferencia termina cuando ambos sistemas alcanzan la misma energia media: la misma temperatura, a la energia intercambiada la denominamos calor Q.
Hemos visto tambien como si dejamos expansionar un gas contra un piston el gas realiza un trabajo, W, disminuyendo su energia interna U. Estableceremos pues la conservacion de la energia para estas magnitudes lo que se conoce como Primer Principio de la Termodinamica.
El signo menos lo ponemos porque consideraremos, por convenio, que el trabajo es positivo si lo realiza el sistema y negativo si se realiza sobre el sistema.
Vamos a realizar algunas experiencias en las que nos familiarizaremos con esta expresion en diversas circunstancias. Primeramente veremos una experiencia en la que un gas se expansiona contra una pared movil, en el proceso no hay intercambio de calor con los alrededores a este tipo de procesos en los que no hay intercambio de calor les llamamos adiabaticos.
En el diagrama PV del proceso isotermo la curva que describe el proceso es una rama de hiperbola dado que al no variar la temperatura el producto de la presion por el volumen permanecera constante no sera asi en el adiabatico.
TRABAJO EN UN PROCESO ISOTERMO
Recordando la ecuacion de los gases ideales introducida en el apartado 3. TEMPERATURA, el trabajo de un gas en un proceso isotermo vendra dado por:
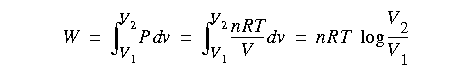
Donde n es el numero de moles, por lo que se modifica la constante que aparece en la esperesion y la llamamos R.
