Elementos Químicos y Moléculas
Todas las formas de materia, tanto los seres vivos como los objetos inanimados, están compuestas por un número limitado de unidades estructurales llamadas elementos químicos, cada uno de los cuales es una sustancia que no se puede descomponer en sustancias más simples mediante reacciones químicas comúnes.
 Hasta el momento se han identificado 109 elementos de los cuales 92 se encuentran en la naturaleza. Los restantes se han producido a partir de otros mediante dispositivos especiales. Todos ellos se representan mediante símbolos químicos formados por la primera o las dos primeras letras de su nombre en latín.
Hasta el momento se han identificado 109 elementos de los cuales 92 se encuentran en la naturaleza. Los restantes se han producido a partir de otros mediante dispositivos especiales. Todos ellos se representan mediante símbolos químicos formados por la primera o las dos primeras letras de su nombre en latín.
Los elementos químicos se representan en una tabla que se conoce con el nombre de tabla periódica de los elementos. En dicha tabla los elementos se clasifican según sus propiedades físicas y químicas.
El cuerpo humano contiene 26 de los 92 elementos que se pueden encontrar en la naturaleza. De ellos sólo 4, oxígeno (O), carbono (C), hidrógeno (H) y nitrógeno (N), constituyen alrededor del 96% de la masa corporal y se denominan elementos principales. El resto se clasifican en elementos secundarios, que forman un 3.9% de la masa corporal, y oligoelementos, que se hallan en concentraciones minúsculas en el organismo y constituyen el 0.1% restante.
| Clasificación |
% en la materia viva
|
Elementos químicos
|
| Principales |
96% |
O, C, H y N
|
| Secundarios |
3.9% |
Ca, P, K, S, Na, Cl, Mg, I y Fe
|
| Oligoelementos |
0.1% |
Al, B, Cr ,Co , Cu ,F , Mn , Mo, Se , Si, Sn , V y Zn
|
 Actividad
Actividad
 ¿Quieres saber más acerca de los elementos químicos?
¿Quieres saber más acerca de los elementos químicos?
La siguiente página web contiene amplia información sobre los elementos químicos y la tabla periódica.
El C, H y el O aparecen en todo tipo de materia orgánica. Las proteínas tienen además N. En cuanto a los elementos secundarios y oligoelementos, tienen múltiples acciones en el organismo. Son imprescindibles para las funciones biológicas. A continuación tienes algunos de ellos y sus funciones más importantes.
Calcio (Ca)
|
Forma parte de los carbonatos de calcio de estructuras esqueléticas. En forma iónica interviene en la contracción muscular, coagulación sanguínea y transmisión del impulso nervioso.
|
|
Fósforo (P)
|
Forma parte de los nucleótidos, compuestos que forman los ácidos nucleicos. Forma parte de coenzimas y otras moléculas como fosfolípidos, que son componentes fundamentales de las membranas celulares. Compone los fosfatos, sales minerales abundantes en los seres vivos.
|
Potasio (K)
|
Es el catión más abundante en el interior celular. Es necesario para la conducción nerviosa y la contracción muscular.
|
Azufre (S)
|
Se encuentra en dos aminoácidos (cisteína y metionina), presentes en todas las proteínas.
|
| Magnesio(Mg) |
Actúa como catalizador, junto con las enzimas en muchas reacciones químicas del organismo.
|
Sodio (Na)
|
Catión abundante en el medio extracelular;necesario para la conducción nerviosa y la contracción muscular.
|
Cloro (Cl)
|
Anión más frecuente; necesario para mantener el balance de agua entre la sangre y el fluído intersticial.
|
Hierro (Fe)
|
Interviene en reacciones químicas del organismo, formando parte de los citocromos que intervienen en la respiración celular. Forma parte de la hemoglobina participando en el transporte de oxígeno.
|
Iodo (I)
|
Necesario para la síntesis de la tiroxina, hormona que interviene en el metabolismo.
|
Cromo (Cr)
|
Interviene junto a la insulina en la regulación de la glucosa en sangre.
|
Cobalto (Co)
|
Forma parte de la vitamina B12, necesaria para la síntesis de hemoglobina.
|
Flúor (F)
|
Forma parte del esmalte dentario y de los huesos.
|
Silicio (Si)
|
Proporciona resistencia al tejido conjuntivo.
|
Cada elemento se compone de átomos, que son las unidades más pequeñas que conservan todas las propiedades y características del elemento.
Los átomos a su vez están formados por tres clases de partículas subatómicas, protones, neutrones y electrones.
 Pincha en el dibujo para ver la estructura del átomo de litio
Pincha en el dibujo para ver la estructura del átomo de litio
La parte central del átomo constituye el núcleo y contiene los protones (partículas cargadas positivamente) y neutrones (partículas sin carga). Los electrones, que tienen carga negativa, giran en un amplio espacio alrededor del núcleo.
El número de electrones (-) siempre es igual al de protones (+), por lo que las cargas se equilibran y hacen que el átomo sea eléctricamente neutro.
|
 Se llama número atómico al número de protones que hay en el núcleo de un átomo. El número atómico es lo que distingue a los átomos de un elemento de los demás. Se llama número atómico al número de protones que hay en el núcleo de un átomo. El número atómico es lo que distingue a los átomos de un elemento de los demás.
|
Los diferentes elementos químicos se combinan entre sí mediante enlaces químicos para formar moléculas y compuestos. Las moléculas que componen la materia viva reciben el nombre de biomoléculas o principios inmediatos. Hay moléculas que están formadas por átomos de la misma clase como el O2 y hay otras como el H2O, que están formadas por átomos de clases distintas. A las moléculas que están formadas por átomos de distinta clase se les llama también compuestos.
|
 La posibilidad de que un átomo forme un enlace químico con otro depende del número de electrones que hay en su nivel de energía más externo. En condiciones normales, dos o más átomos se unen para lograr tener una estructura estable de ocho electrones en su capa más externa. Un átomo que contiene ocho electrones en su última capa es químicamente estable. A esta regla se le llama la ley del octeto. La posibilidad de que un átomo forme un enlace químico con otro depende del número de electrones que hay en su nivel de energía más externo. En condiciones normales, dos o más átomos se unen para lograr tener una estructura estable de ocho electrones en su capa más externa. Un átomo que contiene ocho electrones en su última capa es químicamente estable. A esta regla se le llama la ley del octeto.
|
Cuando los átomos de un elemento interactúan con los de otro lo hacen de una manera característica. Pueden perder, ganar o compartir electrones.
Cuando un átomo gana o pierde electrones se convierte en un ión. Se llama catión al átomo que pierde electrones y queda con carga positiva pues tiene más protones que electrones. Se llama anión si gana electrones. En este caso el número de electrones supera al de protones.
Los iones se representan con el símbolo químico y un exponente que indica el número de cargas positivas o negativas.
Ex: Ca2+ Esto significa que el átomo de calcio ha perdido dos electrones y ha quedado en forma de catión con dos cargas positivas.
ENLACES QUÍMICOS
Los iones que tienen carga positiva atraen a los de carga negativa y viceversa. Esta fuerza de atracción se llama enlace iónico.
Utilizaremos como ejemplo la formación de un compuesto iónico, el cloruro sódico (NaCl) para explicar como se forma este tipo de enlace. El sodio tiene un electrón en su última capa; si lo pierde queda con ocho electrones en la siguiente capa. En consecuencia, el sodio se convierte en un catión o ión con carga positiva (Na+). Por otra parte, el cloro tiene siete electrones en su última capa; si gana un electrón completará ocho electrones en dicha capa. En tal caso el cloro se convertirá en un anión o en un ión con carga negativa (Cl-). Si un átomo de sodio dona su único electrón de la capa más externa a un átomo de cloro, las cargas positiva y negativa harán que los iones se mantengan estrechamente unidos mediante enlace iónico formando el NaCl o sal común.
Los enlaces covalentes son enlaces más fuertes que los iónicos y se producen cuando dos átomos comparten uno, dos o tres pares de electrones. Estos enlaces son los más comúnes en el cuerpo humano y los compuestos que resultan de ellos forman la mayoría de las estructuras corporales. El átomo de hidrógeno tiene un sólo electrón en su capa externa. Por tanto siempre forma un enlace covalente compartiendo dicho electrón.

Haz click sobre el botón Play del cuadro correspondiente y observa como se forman el NaCl y el H2.
Existe un tercer tipo de unión química entre átomos que se denomina puente de hidrógeno. El puente de hidrógeno es una fuerza de atracción débil entre un átomo de hidrógeno y un átomo cercano de oxígeno, nitrógeno o flúor. Este tipo de uniones pueden darse entre átomos de moléculas vecinas o entre átomos de distintas partes de una misma molécula. Aunque es un enlace débil es el responsable del plegamiento de las moléculas de proteína y de la unión de entre las dos cadenas de una molécula de ADN.
Una molécula de agua (H2O) forma puente de hidrógeno con otras cuatro moléculas de agua, de manera que cada molécula se alinea con sus vecinas. Estos enlaces son los responsables de muchas de las propiedades del agua.
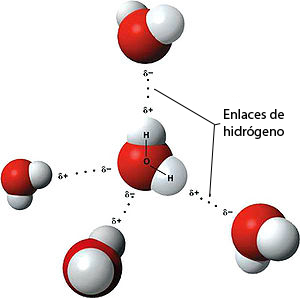 Cada molécula de H2O está formada por dos átomos de hidrógeno (H) y un átomo de oxígeno (O). Los puentes de hidrógeno se forman entre los átomos de hidrógeno y los de oxígeno de distintas moléculas. Los átomos de hidrógeno aparecen en color blanco en la figura y los de oxígeno en color rojo.
Cada molécula de H2O está formada por dos átomos de hidrógeno (H) y un átomo de oxígeno (O). Los puentes de hidrógeno se forman entre los átomos de hidrógeno y los de oxígeno de distintas moléculas. Los átomos de hidrógeno aparecen en color blanco en la figura y los de oxígeno en color rojo.
 Pregunta
Pregunta
¿Cuál de las siguientes afirmaciones respecto a los átomos es cierta?
Incorrecto
Incorrecto
Correcto
Incorrecto
 Pregunta
Pregunta
El enlace que se establece entre el oxígeno y el hidrógeno en una molécula de agua es:
Incorrecto
Correcto
Incorrecto
Incorrecto
 Pregunta
Pregunta
¿Cuál de los siguientes es un enlace covalente apolar?
Correcto
Incorrecto
Incorrecto
Incorrecto
 Pregunta
Pregunta
El tipo de enlace que se forma entre dos moléculas de agua es:
Incorrecto
Incorrecto
Incorrecto
Correcto
 Actividad
Actividad
Compruebe sus conocimientos de conceptos y principios
Compare y contraste los enlaces covalentes apolares, los enlaces covalentes polares y los enlaces iónicos.
 Actividad de Espacios en Blanco
Actividad de Espacios en Blanco
Read the paragraph below and fill in the missing words.
 Actividad de Espacios en Blanco
Actividad de Espacios en Blanco
Read the paragraph below and fill in the missing words.
 Actividad
Actividad
Utilice la tabla periódica de los elementos para responder las siguientes preguntas. Un átomo de sodio tienen 11 protones en el núcleo.
a. ¿Cuántos electrones tiene el átomo?.
b. ¿Cuál es la carga eléctrica del átomo?.
c. ¿Cuántos neutrones tiene el átomo promedio?.
d. Si el átomo pierde un electrón, se le denomina ________ .
e. ¿Cuál sería la carga eléctrica de la sustancia formada en d?.
f. Escriba el símbolo químico al que se hace referencia en d.
¿En qué se convierte el átomo de sodio si pierde un protón del núcleo?
Fisiología Humana. Curso 2011/2012. Juan Manuel Moreno (original de Mayte Llinás y Francisca Rodríguez)
 Hasta el momento se han identificado 109 elementos de los cuales 92 se encuentran en la naturaleza. Los restantes se han producido a partir de otros mediante dispositivos especiales. Todos ellos se representan mediante símbolos químicos formados por la primera o las dos primeras letras de su nombre en latín.
Hasta el momento se han identificado 109 elementos de los cuales 92 se encuentran en la naturaleza. Los restantes se han producido a partir de otros mediante dispositivos especiales. Todos ellos se representan mediante símbolos químicos formados por la primera o las dos primeras letras de su nombre en latín.
 ¿Quieres saber más acerca de los elementos químicos?
¿Quieres saber más acerca de los elementos químicos?

 Cada molécula de H2O está formada por dos átomos de hidrógeno (H) y un átomo de oxígeno (O). Los puentes de hidrógeno se forman entre los átomos de hidrógeno y los de oxígeno de distintas moléculas. Los átomos de hidrógeno aparecen en color blanco en la figura y los de oxígeno en color rojo.
Cada molécula de H2O está formada por dos átomos de hidrógeno (H) y un átomo de oxígeno (O). Los puentes de hidrógeno se forman entre los átomos de hidrógeno y los de oxígeno de distintas moléculas. Los átomos de hidrógeno aparecen en color blanco en la figura y los de oxígeno en color rojo.
