Ácidos, bases y escala de pH
Los enlaces que se
establecen en las moléculas de agua y que mantienen unidos el hidrógeno y el
oxígeno son, como ya se ha señalado, enlaces covalentes polares. Aunque estos
enlaces son fuertes, una pequeña proporción de los mismos se rompe cuando el
electrón del átomo de hidrógeno se transfiere de manera completa al oxígeno.
Cuando sucede esto, la molécula de agua se ioniza con formación de un ion
hidroxilo (OH-) y un ion hidrógeno (H+), que es simplemente un protón libre
La ionización de
las moléculas de agua da lugar a cantidades iguales de OH- y de H+. Debido a que
sólo presenta ionización una pequeña proporción de moléculas de agua, las
concentraciones de H+ y de OH- son de sólo 10-7 molar (el término molar es una
unidad de concentración; para el hidrógeno, 1
molar equivale a
¡Observación! mientras el H+ forma parte de la molécula del ácido carbónico no produce acidez, pero cuando se encuentra libre sí.
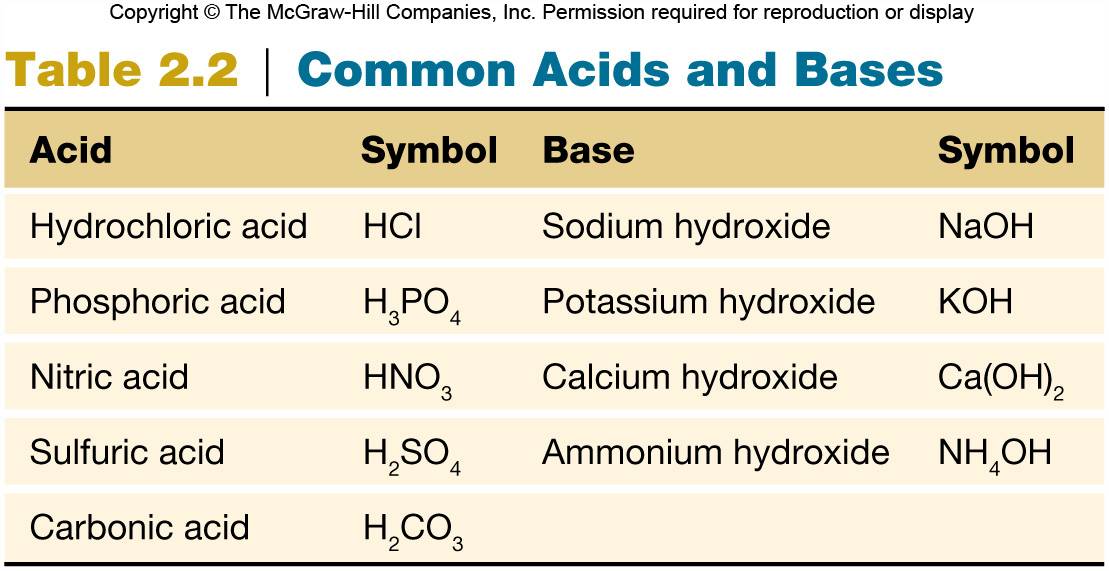
| Una base puede ser una molécula como el amoníaco (NH3) que puede combinarse con H+ (para formar el ion amonio, NH4+). Más habitualmente, es una molécula como el NaOH que puede ionizarse para dar un ión con carga negativa (hidroxilo, OH-) que, a su vez, puede combinarse con H+ (para formar el agua, H2O). Así, una base elimina H+ de la solución; es un «aceptor de protones» que hace disminuir la concentración de H+ de la solución. En la tabla siguiente se recogen varios ejemplos de ácidos y bases comunes. |
|
|
pH
|
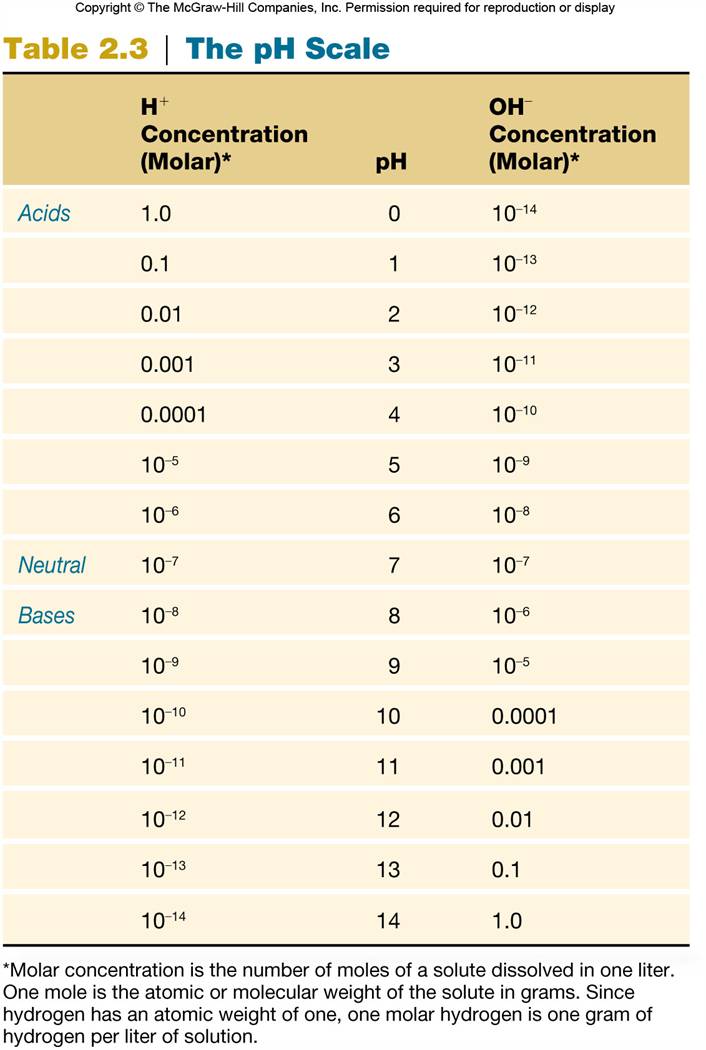
La concentración de
H+ en una solución se suele indicar en unidades de pH en una escala de pH que
va desde 0 hasta 14. El valor del pH es igual al logaritmo de 1 dividido por la
concentración de H+:
pH = log 1 / [H+]
donde [H+] = concentración
molar de H+. Esta fórmula también se puede expresar como pH = –log [H+]
El agua pura tiene
una concentración de H+ de 10-7 molar a El valor del pH es más fácil de escribir que la concentración molar de H+, pero es claramente un elemento de confusión debido a que está relacionado de manera inversa con la concentración de H+, es decir, una solución con una concentración mayor de H+ tiene un pH menor y viceversa. Por ejemplo, un ácido fuerte con una concentración elevada de H+ de 10-2 molar tiene un pH de 2, mientras que una solución que sólo presenta una concentración molar de H+ de 10-10 tiene un pH de 10. Así, las soluciones ácidas tienen un pH inferior a 7 (el del agua pura), mientras que las soluciones básicas (alcalinas) tienen un pH entre 7 y 14 (ver tabla).
|
|
|
Amortiguadores
Un amortiguador es
un sistema de moléculas e iones que actúa para prevenir las modificaciones de
la concentración de H+ y, por tanto, sirve para estabilizar el pH de una
solución. Por ejemplo, en el plasma sanguíneo el pH se estabiliza mediante una
reacción reversible en la que  participan el ión bicarbonato (HCO3-) y el ácido
carbónico (H2CO3):
participan el ión bicarbonato (HCO3-) y el ácido
carbónico (H2CO3):
La flecha en las dos direcciones indica que la reacción puede ir hacia la derecha o hacia la izquierda; la dirección neta depende de la concentración de moléculas e iones en cada lado. Por ejemplo, si un ácido (como el ácido láctico) libera iones H+ hacia la solución, el aumento de la concentración de H+ desplazará el equilibrio hacia la derecha y tendrá lugar la reacción siguiente:
pH sanguíneo
El ácido láctico y
otros ácidos orgánicos son producidos por las células del cuerpo y secretados
hacia la sangre. A pesar de la liberación de H+ por parte de estos ácidos, el
pH de la sangre arterial normalmente no disminuye sino que permanece constante
en valores de 7.40 ± 0.05. Esta constancia se consigue en parte mediante el
efecto de amortiguación que ejerce el bicarbonato en la ecuación ya señalada.
El bicarbonato es el principal sistema de amortiguación de la sangre.
Diversas situaciones pueden dar lugar a una modificación del pH en sentido contrario. Por ejemplo, los vómitos excesivos que causan la pérdida del ácido gástrico también pueden inducir la disminución de la concentración de H+ libre en sangre con incremento del pH sanguíneo. En este caso, se puede invertir la reacción descrita previamente:
La disociación del
ácido carbónico da lugar a la aparición de H+ libre, que es útil para impedir
el incremento del pH. Así, los iones bicarbonato y el ácido carbónico actúan
como un par de amortiguación para impedir la disminución o el aumento del pH,
respectivamente. Este efecto de amortiguación mantiene normalmente el pH
sanguíneo dentro de un intervalo estrecho de
Cuando el pH de la
sangre arterial baja de 7.35, el estado resultante se denomina acidosis. Por
ejemplo, un pH sanguíneo de 7.20 representa una acidosis importante. Es
destacable el hecho de que la sangre con acidosis no es necesariamente ácida.
Por el contrario, el aumento del pH sanguíneo por encima de 7.45 se denomina
alcalosis. La acidosis y la alcalosis se evitan normalmente por la acción del
par de amortiguación bicarbonato/ácido carbónico y por las funciones de los
pulmones y los riñones.
Juan Manuel Moreno Ayuso. Departamento de Fisiología Humana -Medicina-, Espinardo (Murcia).