Enlaces químicos, moléculas y compuestos iónicos
|
Las moléculas se forman por la interacción de los electrones entre dos o más átomos. Estas interacciones, como puede ser compartir electrones, dan lugar a los enlaces químicos (ver figura). El número de enlaces que puede presentar cada átomo está determinado por el número de electrones necesario para completar su orbital más externo. Por ejemplo, el hidrógeno sólo debe conseguir un electrón más para completar la primera capa de dos electrones, por lo que sólo puede formar un enlace químico. |
|
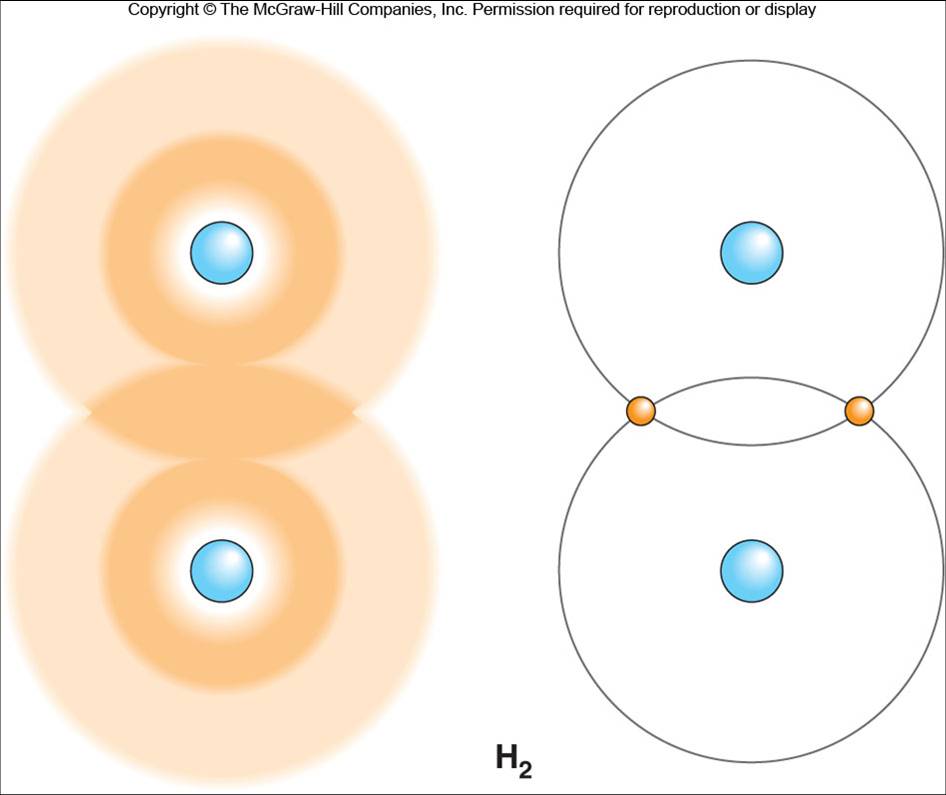
Molécula de hidrógeno con los enlaces covalentes entre los átomos de hidrógeno. Estos enlaces se forman cuando los electrones son compartidos por igual por ambos átomos. |
|
Por el contrario, el carbono debe conseguir cuatro electrones más
para completar la segunda capa de ocho electrones (ver figura), por
lo que puede establecer cuatro enlaces químicos.
|
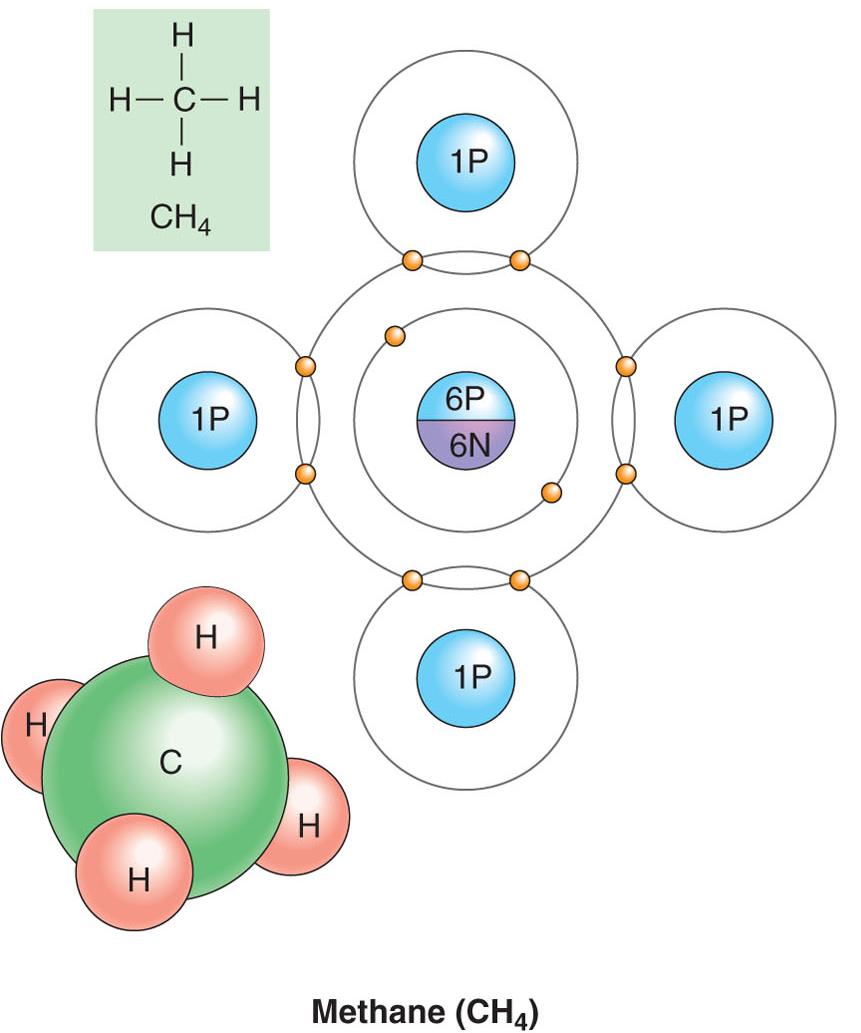
|
En la figura se observa una molécula de metano representada de tres maneras diferentes. Se puede observar que un enlace entre dos átomos está onstituido por un par de electrones compartidos (los electrones de la capa externa de cada átomo. |
Enlaces covalentes
Los enlaces covalentes se establecen cuando los átomos comparten sus electrones de valencia. Los enlaces covalentes que se forman entre átomos idénticos, como ocurre con el gas oxígeno (O2) y el gas hidrógeno (H2), son los más fuertes debido a que sus electrones se comparten por igual. Debido a que los electrones se distribuyen de manera homogénea entre los dos átomos, estas moléculas se denominan apolares.
Los enlaces covalentes apolares también son importantes en los seres vivos. La naturaleza exclusiva de los átomos de carbono y de las moléculas orgánicas formadas a través de enlaces covalentes entre los átomos de carbono proporcionan el fundamento químico de la vida.
Cuando los enlaces covalentes se establecen entre dos átomos diferentes, los electrones pueden ser atraidos más hacia uno de los átomos que hacia el otro. El extremo de la molécula hacia el cual son atraídos los electrones es eléctricamente negativo en comparación con el otro extremo. Se dice que esta molécula es polar (tiene un «polo» positivo y otro negativo). Los átomos de oxígeno, nitrógeno y fósforo tienen una tendencia especialmente intensa a la atracción de los electrones hacia sí mismos cuando establecen enlaces con otros átomos; por tanto, tienden a formar moléculas polares.
|
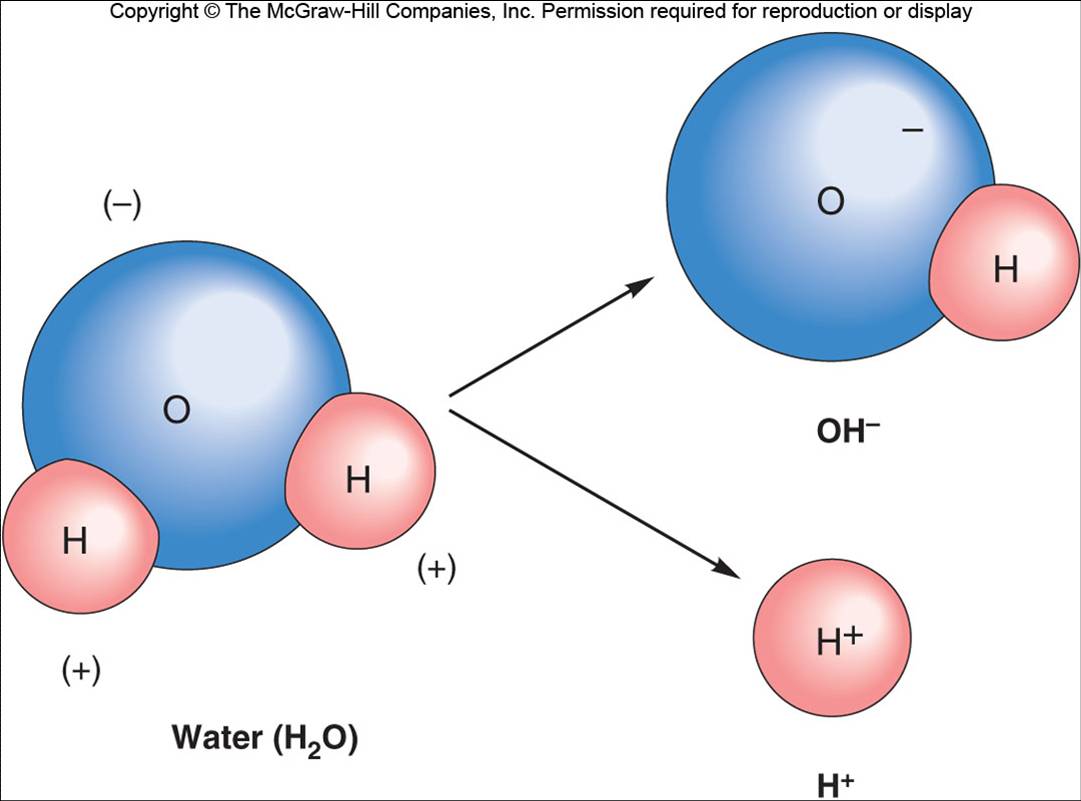
El agua es la molécula más abundante del cuerpo y ejerce un papel de disolvente de los líquidos corporales. El agua es un buen disolvente debido a que es polar; el átomo de oxígeno atrae a los electrones de los dos átomos de hidrógeno hacia el lugar que ocupa en la molécula de agua, de manera que la zona de la molécula ocupada por el oxígeno tiene una carga negativa mayor que la zona ocupada por el hidrógeno (ver figura). En la figura se observa que el lado de la molécula correspondiente al oxígeno es negativo mientras que el lado correspondiente al hidrógeno es positivo. Los enlaces covalentes polares son más débiles que los no polares. Debido a ello, algunas moléculas de agua presentan ionización y forman un ión hidroxilo (OH-) y un ión hidrógeno (H+.) |
|
|
Enlaces iónicos
Los enlaces iónicos tienen lugar cuando uno o más electrones de un átomo se transfieren en su totalidad a un segundo átomo. Así, los electrones no se comparten en absoluto. El primer átomo pierde los electrones, de manera que su número de electrones es menor que su número de protones y, por tanto, queda con carga positiva. Los átomos y las moléculas que tienen carga positiva o negativa se denominan iones. Los iones con carga positiva se denominan cationes debido a que en un campo eléctrico se desplazan hacia el polo negativo o cátodo. Ahora, el segundo átomo tiene un número mayor de electrones que de protones y, por tanto, se transforma en un ión cargado negativamente o anión (debido a que en un campo eléctrico se desplaza hacia el polo positivo). Los cationes y los aniones se atraen entre sí formando un compuesto iónico.
|
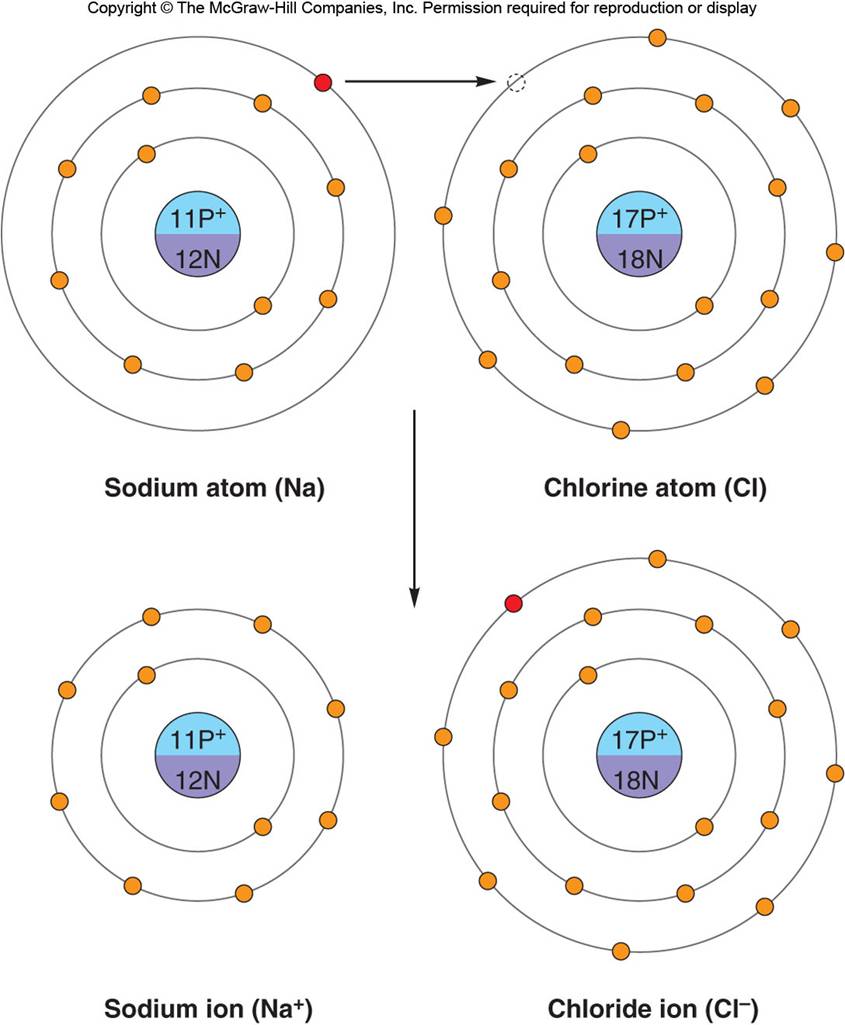
La sal de mesa común, el cloruro sódico (NaCl), es un ejemplo de compuesto iónico. El sodio, con un total de 11 electrones, tiene dos de ellos en su primer orbital, ocho en el segundo y sólo uno en el tercero. Por el contrario, al cloro le falta un electrón para completar su orbital externo de ocho electrones. El electrón solitario del orbital más externo del átomo de sodio es atraído hacia el orbital externo del cloro. Así se forma un ion cloruro (representado como Cl-) y un ion sodio (Na+). Aunque la sal de mesa se suele denominar NaCl, realmente está constituida por Na+Cl- (ver figura). Se observa como los iones positivos de sodio y negatiovs de cloruro se atraen entre sí dando lugar al compuesto iónico cloruro sódico (NaCl).
|
|
|
Los enlaces iónicos son más débiles que los enlaces covalentes polares y, por tanto, los compuestos iónicos se pueden separar (disociar) fácilmente cuando se disuelven en agua. Por ejemplo, la disociación del NaCl da lugar a la producción de Na+ y de Cl-. Cada uno de estos iones ejerce un efecto de atracción sobre moléculas polares de agua; los extremos negativos de las moléculas de agua son atraídos hacia el Na+, y los extremos positivos de las mismas son atraídos hacia el Cl-(ver la figura siguiente). A su vez, las moléculas de agua que rodean a estos iones atraen a otras moléculas de agua formando esferas de hidratación alrededor de cada ión.
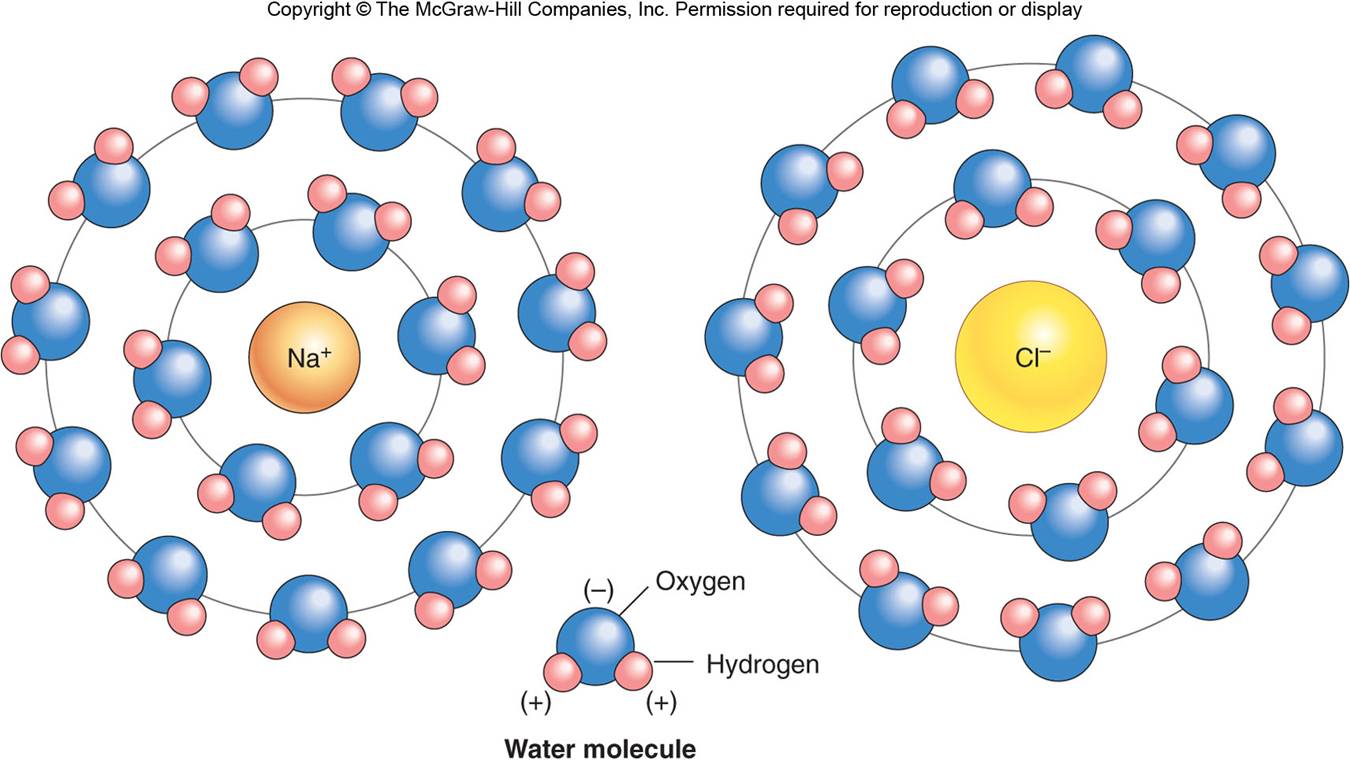
La formación de las esferas de hidratación hace que un ión o una molécula sean solubles en agua. La glucosa, los aminoácidos y muchas otras moléculas orgánicas son hidrosolubles debido a que se pueden formar esferas de hidratación alrededor de los átomos de oxígeno, de nitrógeno y de fósforo, que están unidos mediante enlaces covalentes polares a otros átomos de la molécula. Se dice que estas moléculas son hidrófilas.
Por el contrario, las moléculas constituidas principalmente por enlaces covalentes apolares, como las cadenas de hidrocarburos de las moléculas grasas, presentan menos cargas y, por tanto, no pueden formar esferas de hidratación. Estas moléculas son insolubles en agua y, de hecho, son repelidas por las moléculas de agua. Por estas razones, las moléculas apolares se dice que son hidrófobas.
Enlaces de hidrógeno
|
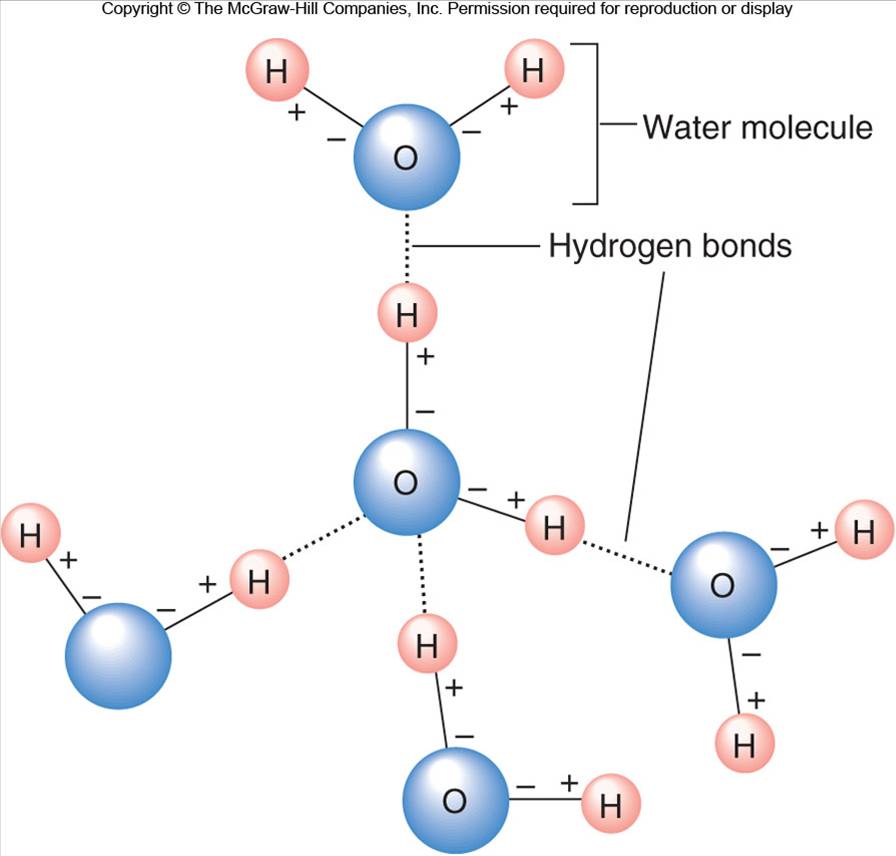
Cuando un átomo de hidrógeno forma un enlace covalente polar con un átomo de oxígeno o de nitrógeno, el hidrógeno obtiene una ligera carga positiva cuando el electrón es atraído hacia el otro átomo. Así, este otro átomo se denomina electronegativo. Debido a que el hidrógeno presenta una ligera carga positiva también muestra una atracción débil por un segundo átomo electronegativo (oxígeno o nitrógeno) que puede estar localizado en su proximidad. Esta atracción débil se denomina enlace de hidrógeno (en ocasiones fuerza de van der Waals). Los enlaces de hidrógeno se suelen representar mediante líneas de guiones o de puntos (ver figura) para diferenciarlos de los enlaces covalentes más fuertes, que se representan mediante líneas continuas. En la figura, los átomos de oxígeno de las moléculas de agua están unidos débilmente debido a la atracción del oxígeno electronegativo por el hidrógeno con carga positiva. Aunque cada enlace de hidrógeno es relativamente débil, la suma de sus fuerzas de atracción es la responsable del plegamiento de las moléculas orgánicas grandes como las proteínas v también del mantenimiento de la unión entre las dos cadenas de una molécula de ADN. Los enlaces de hidrógeno también se pueden establecer entre moléculas de agua adyacentes. El establecimiento de enlaces de hidrógeno entre las moléculas de agua es el responsable de muchas de las importantes propiedades biológicas del agua, como su tensión superficial y su capacidad para ser atraída en forma de columna a través de canales estrechos en un proceso denominado acción capilar. |
|
|
Compruebe sus conocimientos de conceptos y principios
Compare y contraste los enlaces covalentes apolares, los enlaces covalentes polares y los enlaces iónicos.
Juan Manuel Moreno Ayuso. Departamento de Fisiología Humana -Medicina-, Espinardo (Murcia).